Ema: in dieci anni autorizzati oltre 200 farmaci per l’età pediatrica

Tra il 2007 e il 2017 un medicinale su quattro tra quelli approvati nell’Ue ha avuto indicazioni specifiche per l’uso nei bambini. Il punto dell’agenzia regolatoria europea.
Sempre più farmaci per i bambini disponibili in Europa. In dieci anni (2007-2017) sono stati approvati oltre 200 medicinali pediatrici. Tradotto: un medicinale su quattro tra quelli approvati nell’Ue ha avuto indicazioni specifiche per l’uso nei bambini. A fare il punto è l’Agenzia europea dei medicinali (Ema) con una nota (e un’infografica) pubblicata sul suo portale.
L’Ema fa il punto
I bambini e i neonati spesso reagiscono in modo diverso alle medicine rispetto agli adulti. Tuttavia, le informazioni sull'uso nei bambini non sono sempre disponibili e possono essere richiesti moduli specifici e più adatti. Pertanto, è importante che le medicine siano appropriatamente studiate e dimostrate sicure ed efficaci per i bambini.
Nel 2007, il Regolamento Pediatrico ha introdotto un sistema di obblighi, premi e incentivi per incoraggiare i produttori a ricercare e sviluppare farmaci per le specifiche esigenze terapeutiche dei bambini.
Il 2007, preso come riferimento dall’agenzia, è l’anno in cui è stato introdotto nell’Ue il Regolamento europeo per i medicinali a uso pediatrico. Da allora, ricorda l’Ema, ai produttori è stato richiesto di considerare i bisogni terapeutici pediatrici nell’ambito della Ricerca & Sviluppo dei farmaci. A questa iniziativa si è affiancata l’istituzione di un Paediatric Committee (Pdco), che è responsabile per la revisione dei piani di ricerca pediatrici (Pip). Impegni, sottolinea l’agenzia, che hanno aumentato la consapevolezza sul bisogno di studiare i farmaci nei bambini, e che ha fatto sì che la ricerca pediatrica sia ora una “pratica standard” nello sviluppo dei farmaci.
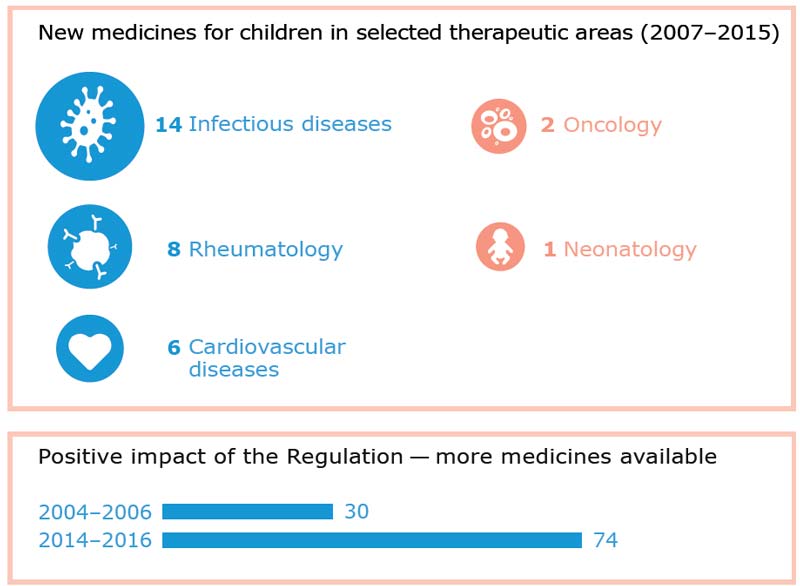
Le aree terapeutiche
In alcune aree terapeutiche, sono arrivate nuove indicazioni per alcuni farmaci, come quelli per le malattie infettive o reumatologiche, portando a cambiamenti positivi nel modo in cui i bambini vengono trattati. In altre aree invece, come quella oncologica e neonatologica, il Regolamento sui farmaci pediatrici sarebbe stato meno efficace. Per questo l’Ema si sta attivando per promuovere iniziative orientate a migliorare la disponibilità di farmaci in queste aree. Avere medicine specifiche per la fascia pediatrica è importante, rileva l’Ema, perché i bambini reagiscono in modo diverso rispetto agli adulti, ed è quindi necessario che siano appositamente studiati, e ne sia dimostrata la sicurezza ed efficacia per i minori.
Cooperazione internazionale
Ema ha anche attivato un network (European network of paediatric research-Enpr) costituito da oltre 40 reti di ricerca, ricercatori e centri di eccellenza nello svolgimento di studi clinici per l’età pediatrica. A livello globale, inoltre, è in atto una proficua collaborazione con la Food and drug administration (Fda) e altri enti regolatori, con riunioni mensili sui i più recenti sviluppi che riguardano i farmaci per l’età pediatrica.

