Il nuovo Piano d’azione EMA 2017-2020 per le PMI

L’innovazione è al centro delle sedici iniziative cross-agenzia a supporto delle piccole e medie imprese farmaceutiche per il triennio 2017-2020, pubblicate dall’Agenzia europea dei medicinali (EMA).
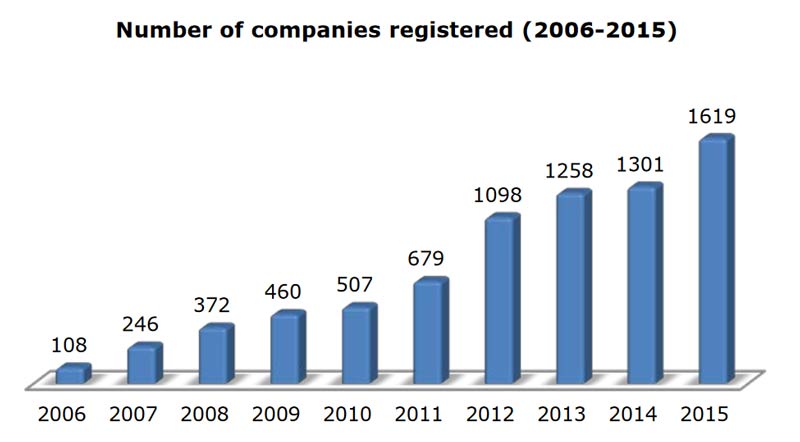
Alla fine del 2015 il numero di PMI registrate presso l’EMA è stato 15 volte più alto che nel 2006, un incremento del 24% comparato con l’anno precedente. Gli aumenti più significativi si sono avuti nel 2012 e nel 2015 che hanno coinciso con gli incentivi per la Farmacovigilanza e per il MedDRA (Medical Dictionary for Regulatory Activities).
Le nuove azioni individuate dall’ente regolatorio europeo trovano fondamento del rapporto pubblicato in occasione del decennale dell’iniziativa rivolta alle PMI (nel 2015) e recepiscono anche il nuovo contesto di collaborazione tra EMA e i partner accademici e il nuovo EU Innovation Network.
L’implementazione del piano includerà tutti i diversi livelli d’azione delle PMI, al fine di promuoverne la crescita, e sarà monitorato attraverso i punti di contatto dedicati all’interno delle diverse divisioni operative di EMA.
Le sedici azioni individuate da EMA sono declinate in quattro diverse aree d’intervento:
Maggior conoscenza dell’iniziativa dedicata alle SME
La penetrazione delle azioni mirate alle piccole e medie imprese dovrà coinvolgere maggiormente anche altri attori del ciclo dell’innovazione, come le università, gli incubatori e gli investitori. Anche l’area dedicata sul sito web di EMA verrà rivista in modo da ottimizzare il flusso informativo e l’utilizzo delle piattaforme informatiche per facilitare il dialogo e le consultazioni pubbliche con gli stakeholder. I registri pubblici delle PMI recepiranno anche informazioni sulle aree emergenti d’innovazione e dati circa le esperienze che queste aziende hanno sviluppato in relazione a procedure quali PRIME, la designazione di farmaci orfani, lo scientific advice e le autorizzazioni all’immissione in commercio.
Rafforzare la formazione regolatoria nelle PMI
Le piccole e medie aziende si trovano spesso in difficoltà a disporre di risorse regolatorie interne adeguate a gestire procedure complesse, a causa delle dimensioni aziendali ridotte. La seconda azione prevede di rafforzare la formazione degli addetti in ambito regolatorio e facilitare il recepimento degli strumenti di supporto e di garanzia del rispetto alla legislazione. Tra le novità a riguardo, EMA prevede di espandere l’attività dell’EU Network Training Centre EU-NTC e di potenziare i canali di e-learning e i webinar destinati specificamente alle PMI.
Favorire l’innovazione per i farmaci umani e veterinari
Oltre a una maggiore collaborazione con il mondo della ricerca universitaria, a cui verrà fornita maggiore informazione sulle procedure di scientific advice e di accesso agli incentivi gratuiti, l’azione prevede anche la promozione presso le PMI di strumenti quali le procedure PRIME per i farmaci orfani, gli schemi di valutazione parallela EMA-HTA, la qualifica delle nuove metodologie e l’autorizzazione condizionata al commercio. L’azione prevede anche di rafforzare la cooperazione con la DG Research della Commissione europea e l’IMI.
Maggior coinvolgimento con gli altri stakeholder
Le piccole e medie imprese potranno disporre di linee guida specifiche nel corso dello sviluppo dei nuovi progetti dell’Agenzia europea dei medicinali, ad esempio il progetto SPOR d’implementazione ISO IDMP. Anche i settori delle tecnologie complementari ai farmaci (dispositivi medici, diagnostici, tecnologie digitali, farmacogenomica e terapie avanzate) saranno oggetto di una comunicazione più mirata da parte dell’Agenzia. EMA prevede anche di stabilire relazioni su base regolare con le altre Agenzie europee che hanno azioni a supporto delle PMI, con la DG Grow e con FDA, per favorire lo scambio di best practice e giungere a una migliore definizione del termine “piccola e media impresa”.

